Τι είναι η γαστρίτιδα;
Γαστρίτιδα είναι η φλεγμονή του βλεννογόνου του στομάχου. Σε μερικούς ανθρώπους η γαστρίτιδα εκδηλώνεται απότομα και διαρκεί για μικρό χρονικό διάστημα (οξεία γαστρίτιδα). Σε άλλους η γαστρίτιδα διαρκεί μήνες ή χρόνια (χρόνια γαστρίτιδα).
Η θεραπεία της γαστρίτιδας είναι σημαντική διότι αν δεν θεραπευθεί συχνά οδηγεί σε:
- Διαβρώσεις ή έλκη (πληγές) στο τοίχωμα του στομάχου ή στο πρώτο τμήμα του λεπτού εντέρου (δωδεκαδάκτυλο)
- Καρκίνο στομάχου
Πώς προκαλείται η γαστρίτιδα;
Η γαστρίτιδα οφείλεται σε διάφορες αιτίες όπως σε:
- Λοίμωξη του στομάχου από ένα κοινό βακτήριο που προσβάλλει περίπου τους μισούς ενήλικες Έλληνες, που ονομάζεται Ελικοβακτηρίδιο του πυλωρού (Helicobacter pylori)
- Φάρμακα όπως ασπιρίνη και μη στεροειδή αντιφλεγμονώδη φάρμακα
- Υπερβολική κατανάλωση αλκοόλ
- Παλινδρόμηση χολής από το δωδεκαδάκτυλο στο στομάχι (αλκαλική γαστρίτιδα)
- Αυτοάνοση γαστρίτιδα
- Στρες
- Χημειοθεραπεία
- Σοβαρές συνοδές παθήσεις
Στο τέλος του παρόντος άρθρου αναλύεται διεξοδικά η παθογένεια της γαστρίτιδας για όσους επιθυμούν να διαβάσουν περισσότερες λεπτομέρειες. Δείτε τις διαφάνειες του Γαστρεντερολόγου Δρ. Χρήστου Ζαβού στο πρόσφατο Πανελλήνιο Συνέδριο Γαστρεντερολογίας για τη Χρόνια γαστρίτιδα
Ποια είναι τα συμπτώματα της γαστρίτιδας;
Η γαστρίτιδα δυνατόν να μην εκδηλώνεται με συμπτώματα όταν πρόκειται για χρόνια νόσο. Συνήθως τα συμπτώματα περιλαμβάνουν:
- Πόνο στην άνω κοιλιά
- Τυμπανισμό, ή αίσθημα πρόωρου κορεσμού με την κατανάλωση μικρής ποσότητας τροφής
- Ανορεξία
- Ναυτία ή έμετο
- Έμετο με αίμα ή κενώσεις μαύρου χρώματος
- Εύκολη κόπωση λόγω συνυπάρχουσας αναιμίας, δηλαδή χαμηλού αιματοκρίτη
Πότε θα πρέπει να απευθυνθώ σε γαστρεντερολόγο;
Ζητήστε βοήθεια από γαστρεντερολόγο εάν:
- Έχετε πόνο στην κοιλιά που επιδεινώνεται ή δεν υποχωρεί
- Κάνετε εμετό με αίμα ή βλέπετε μαύρες κενώσεις
- Χάνετε βάρος (χωρίς να κάνετε δίαιτα για να χάσετε βάρος)
Υπάρχει ειδική εξέταση για τη γαστρίτιδα;
Ναι. Ο γαστρεντερολόγος αφού λάβει ιστορικό και σας εξετάσει κλινικά, θα σας συστήσει να κάνετε ενδοσκόπηση ανωτέρου πεπτικού (γαστροσκόπηση).
Στην γαστροσκόπηση, θα σας χορηγηθεί φάρμακο (μέθη) για να σας βοηθήσει να χαλαρώσετε. Στη συνέχεια, ο γαστρεντερολόγος-ενδοσκόπος θα εισαγάγει ένα λεπτό, εύκαμπτο σωλήνα στο στόμα σας και θα τον προωθήσει στον οισοφάγο, το στομάχι και το δωδεκαδάκτυλο (το πρώτο τμήμα του λεπτού εντέρου). Ο σωλήνας διαθέτει κάμερα που συνδέεται με οθόνη ώστε να γίνει έλεγχος στο στομάχι. Ο γαστρεντερολόγος έχει την δυνατότητα κατά την γαστροσκόπηση να λάβει βιοψίες από το στομάχι ώστε να γίνει στην συνέχεια έλεγχος από τον παθολογοανατόμο εάν υπάρχουν βακτήρια του τύπου του Ελικοβακτηριδίου του πυλωρού (Helicobacter pylori).
Ο γαστρεντερολόγος σας ενδεχομένως να σας ζητήσει αιματολογικές εξετάσεις για έλεγχο αναιμίας (χαμηλού αιματοκρίτη), ή ακτινολογικές εξετάσεις (βαριούχο γεύμα).
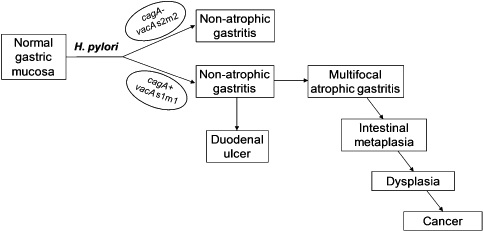
Ποια είναι τα στάδια της γαστρίτιδας από το Ελικοβακτηρίδιο του πυλωρού κατά Correa;
Σύμφωνα με το μοντέλο πρόκλησης καρκίνου του στομάχου από το Ελικοβακτηρίδιο του πυλωρού που προτάθηκε από τον Correa, υφίστανται τα ακόλουθα 5 στάδια:
- Χρόνια ενεργός μη ατροφική γαστρίτιδα
- Πολυεστιακή ατροφική γαστρίτιδα
- Εντερική μεταπλασία
- Δυσπλασία (χαμηλόβαθμη και υψηλόβαθμη)
- Καρκίνος στομάχου
Η εντερική μεταπλασία θεωρείται το σημείο δίχως επιστροφή (point of no return), δηλαδή δεν υποχωρεί έπειτα από την εκρίζωση του Ελικοβακτηριδίου του πυλωρού. Γενικώς θεωρείται ότι η εντερική μεταπλασία είναι ένα προστάδιο του γαστρικού αδενοκαρκινώματος, γι’ αυτό ο ασθενής με εντερική μεταπλασία θα πρέπει να τίθεται σε πρόγραμμα τακτικής παρακολούθησης με γαστροσκόπηση και βιοψίες. Καρκίνος μπορεί να αναπτυχθεί και σε περιοχές χωρίς εντερική μεταπλασία, που σημαίνει ότι η εντερική μεταπλασία λειτουργεί περισσότερο ως βιοδείκτης για την ανάπτυξη καρκίνου στομάχου.
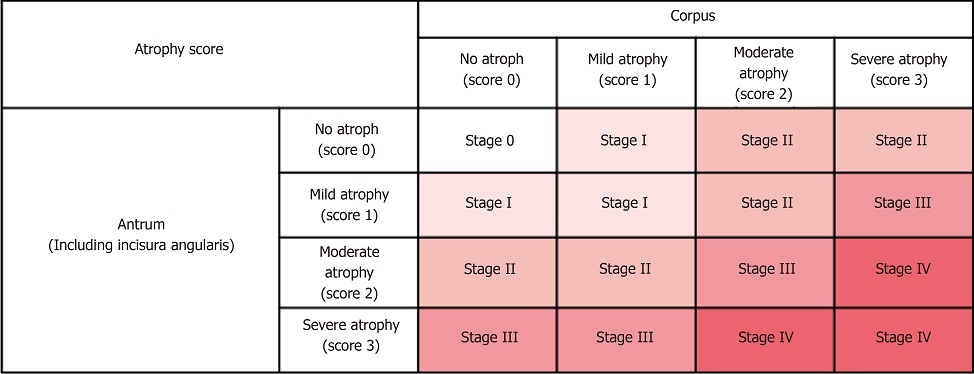
Πώς γίνεται η εκτίμηση της ατροφικής γαστρίτιδας;
Η εκτίμηση της ατροφικής γαστρίτιδας γίνεται με το σύστημα OLGA (Operative Link for Gastritis Assessment). Η ατροφική γαστρίτιδα περιλαμβάνει τα εξής στάδια: 0 (απουσία ατροφίας), 1 (ήπια ατροφία), 2 (μέτρια ατροφία), 3 (σοβαρή ατροφία). Ο γαστρεντερολόγος οφείλει να πάρει βιοψίες από το άντρο, το σώμα και τη γωνία του στομάχου.
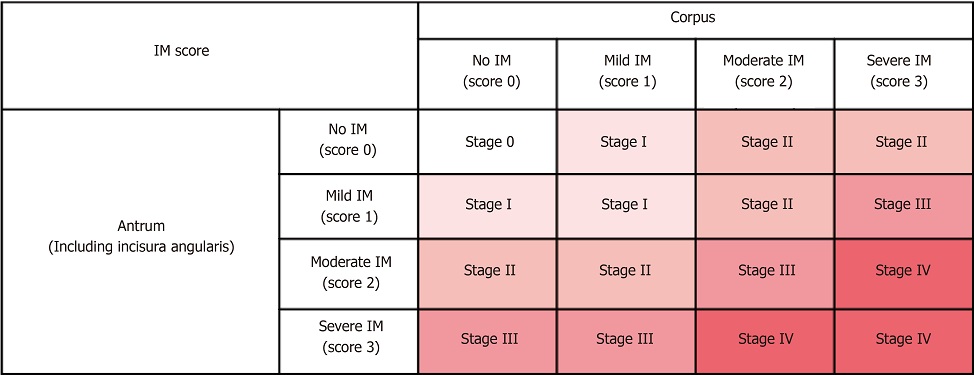
Πώς γίνεται η εκτίμηση της εντερικής μεταπλασίας;
Η εκτίμηση της εντερικής μεταπλασίας γίνεται με το σύστημα OLGIM (Operative Link for Gastric Intestinal Metaplasia assessment). Η εντερική μεταπλασία περιλαμβάνει τα εξής στάδια: 0 (απουσία εντερικής μεταπλασίας), 1 (ήπια εντερική μεταπλασία), 2 (μέτρια εντερική μεταπλασία), 3 (σοβαρή εντερική μεταπλασία). Ο γαστρεντερολόγος οφείλει να πάρει βιοψίες από το άντρο, το σώμα και τη γωνία του στομάχου.
Πώς αντιμετωπίζεται η γαστρίτιδα;
Η θεραπεία της γαστρίτιδας εξαρτάται από το τι προκαλεί την γαστρίτιδα. Για παράδειγμα, αν η γαστρίτιδα οφείλεται σε φάρμακα προκαλούν γαστρίτιδα, ο γαστρεντερολόγος θα σας συστήσει να μην λαμβάνετε αυτά τα φάρμακα. Αν το αλκοόλ ευθύνεται για την γαστρίτιδά σας, ο γαστρεντερολόγος θα σας συστήσει να σταματήσετε την κατανάλωση αλκοόλ. Εάν βρεθεί λοίμωξη από Ελικοβακτηρίδιο του πυλωρού (Helicobacter pylori) ο γαστρεντερολόγος θα σας συστήσει να λάβετε αντιβιοτική θεραπεία για την εκρίζωση του Ελικοβακτηριδίου. Υπάρχουν φάρμακα που βελτιώνουν την γαστρίτιδα όπως οι αναστολείς της έκκρισης οξέος από το στομάχι. Ο γαστρεντερολόγος θα σας υποδείξει την κατάλληλη για εσάς αγωγή.
Τι θα κάνω μετά τη θεραπεία για τη γαστρίτιδα;
Οι ασθενείς που θα λάβουν θεραπεία για την λοίμωξη από Ελικοβακτηρίδιο του πυλωρού (Helicobacter pylori) χρειάζονται επαναληπτικές εξετάσεις για να βεβαιωθεί ότι η λοίμωξη έχει εκριζωθεί. Οι επαναληπτικές εξετάσεις περιλαμβάνουν έλεγχο με δοκιμασία ουρίας αναπνοής ή νέα ενδοσκόπηση (γαστροσκόπηση).
Ποια είναι η ακριβής παθογένεια της γαστρίτιδας; [Ενότητα για ειδικούς]
Γενικά, εξακολουθεί να ισχύει η παραδοσιακή ιστολογική κατάταξη της γαστρίτιδας σε επιπολής γαστρίτιδα, ατροφική (εν τω βάθει) γαστρίτιδα και γαστρική ατροφία. Το ίδιο ισχύει και με την ανοσολογική –ιστολογική κατάταξη της νόσου σε αυτοάνοση (τύπου Α) και μη αυτοάνοση (τύπου Β) γαστρίτιδα. Τα τελευταία έτη δόθηκε ερευνητική έμφαση στην παθογένεση της νόσου. Η κυτταρική ανοσία φαίνεται να παίζει βασικό ρόλο στις γαστρίτιδες τύπου Α και Β, ο δε διαχωρισμός στους δύο αυτούς τύπους πιθανόν να γίνεται, κατά κύριο λόγο, κατόπιν ελέγχου της κυτταρικής αντιδράσεως προς γαστρικά αντιγόνα παρά κατόπιν προσδιορισμού των τοιχωματικών αυτοαντισωμάτων.1
Ιδιαίτερη παθογενετική προσέγγιση έγινε στην χρόνια αυτοάνοση γαστρίτιδα (φλεγμονώδη εξεργασία του σώματος του στομάχου χωρίς πρόδηλα συμπτώματα εκτός επί αναπτύξεως βλεννογονικής ατροφίας με εκδηλώσεις δυσαπορρόφησης βιταμίνης Β12 και σιδήρου). Η γαστρική H+,K+ -adenosine triphospatase (ATPase), γνωστή ως αντλία πρωτονίων των τοιχωματικών κυττάρων, έχει αναγνωρισθεί (με PCR) ως το κύριο αυτοαντιγόνο-κλειδί που εμπλέκεται στην ανάπτυξη γαστρικής βλάβης,2 χαρακτηριζόμενη από φλεγμονώδη κυτταρική διήθηση του γαστρικού βλεννογόνου και απώλεια των τοιχωματικών κυττάρων.
Η χορήγηση αντιγόνων της αντλίας πρωτονίων σε νεογέννητα πειραματόζωα οδηγεί σε ανάπτυξη αυτοάνοσης γαστρίτιδας στην ενήλικη ζωή τους.3 Ιn vivo, γαστρικοί Τ- λεμφοκυτταρικοί κλώνοι ενεργοποιούνται σε απάντηση έναντι της H+,K+ -ATPάσης και εκδηλώνουν ικανότητα παραγωγής κυτταροκινών.2 Ειδικότερα, μια αναλογία (25%) των CD4+ κλώνων του βλεννογόνου του σώματος του στομάχου ασθενών με χρόνια αυτοάνοση γαστρίτιδα εμφανίζουν πολλαπλασιαστική ικανότητα έναντι της H+,K+ -ATPάσης. Οι πλείστοι αυτών των κλώνων (88%) επάγουν Th1 προφίλ κυτταροκινών, ενώ ένα μικρό ποσοστό εκκρίνει Th1 και Th2 κυτταροκίνες.2
Επίσης, σε πειραματικά μοντέλα αυτοάνοσης ηπατίτιδας μόνο Τh1-κύτταρα συσσωρεύονται στον φλεγμονώδη γαστρικό βλεννογόνο, ενώ στους τοπικούς λεμφαδένες ανευρίσκονται Τh1 και Τh2 λεμφοκύτταρα.4 Ουσιωδώς όλοι οι H+,K+ -ATPάση-ειδικοί λεμφοκυτταρικοί κλώνοι παράγουν TNF-α, παρέχουν βοήθεια στην παραγωγή αυτοαντισωμάτων από τα Β-λεμφοκύτταρα και επάγουν την Fas-FasL (σύμπλεγμα συνδέτου του θανάτου)–μεσολαβούσα απόπτωση των κυττάρων στόχων. Κατά συνέπεια, η ενεργοποίηση των H+,K+-ATPάση-ειδικών Τh1 κυτταροτοξικών/προαποπτωτικών Τ-λεμφοκυττάρων στον γαστρικό βλεννογόνο φαίνεται ότι αντιπροσωπεύει τον κύριο εκτελεστικό μηχανισμό καταστροφής των κυττάρων στόχων στην χρόνια αυτοάνοση γαστρίτιδα,2 δεδομένα που δυνατόν να ανοίγουν νέους ορίζοντες μελλοντικής ανοσοπαρεμβατικής προσέγγισης της νοσολογικής αυτής οντότητας με τις δυνητικές σοβαρές επιπτώσεις της.
Το Η. pylori αποτελεί σπουδαίο παθογενετικό παράγοντα για ανάπτυξη χρόνιας γαστρίτιδας τύπου Β, πεπτικού έλκους και γαστρικού καρκίνου.5-7 Η παραγωγή τοξικών ριζών Ο2 (ROΜs) σε σχέση με το H. pylori έχει δειχθεί in vitro και in vivo, παίζει δε κύριο ρόλο στην H. pylori σχετιζόμενη γαστρική και δωδεκαδακτυλική νόσο.7 Η H. pylori-σχετιζόμενη βλεννογονική φλεγμονή χαρακτηρίζεται από πολυμορφοπυρηνική (PMN) λευκοκυτταρική διήθηση, η δε ενεργοποίηση των ουδετεροφίλων παρέχει την κύρια πηγή των ROMs.8
Διαπιστώνεται ότι τα θετικά σε κυτταροξίνες H. pylori (cagA-θετικά) στελέχη σχετίζονται με αυξημένη επαγωγή του οξειδωτικού στρες των PMNs και συνοδό παρουσία γαστροδωδεκαδακτυλικής βλάβης παρά τα αρνητικά σε κυτταροξίνες στελέχη.8,9 Ο βαθμός του PMN- οξειδωτικού στρες (oxidative burst) σχετίζεται με το βαθμό της PMN-διηθήσεως του γαστρικού βλεννογόνου.9 Η PMN πυροδότηση, προφανώς ως συνέπεια δράσεως διαλυτών μεσολαβητών των μονοπυρήνων, καθιστά τα PMN υπερευαίσθητα στα H. pylori παράγωγα, ευνοώντας την απελευθέρωση μεγάλων ποσοτήτων ROMs και πρωτεασών με σκοπό τη θανάτωση του βακτηριδίου.8
Εντούτοις, το H. pylori φαίνεται να είναι ιδιαίτερα ανθεκτικό στον οξειδωτικό μηχανισμό των PMN, ο οποίος διαδοχικά προκαλεί βλάβη στο γαστρικό βλεννογόνο του ξενιστή.9 Ενώ το H. pylori παράγει ουσίες που άμεσα βλάπτουν το επιθήλιο, μειώνοντας έτσι την αντίσταση του βλεννογόνου στη γαστρική βλάβη, δύναται και έμμεσα να προκαλεί γαστρική βλάβη προάγοντας τη στρατολόγηση και ενεργοποίηση των φλεγμονωδών αυτών κυττάρων.10
Επισημαίνεται, επίσης, ότι η H. pylori λοίμωξη προκαλεί επιμένουσα διήθηση των ουδετεροφίλων στον ανθρώπινο γαστρικό βλεννογόνο οφειλόμενη σε αναστολή της αποπτωτικής διεργασίας τους, η δε συνεπαγόμενη παράταση της διάρκειας ζωής των ουδετεροφίλων είναι προφανές ότι συμβάλλει στην παθογένεση της H. pylori-σχετιζόμενης γαστρικής βλάβης.11,12 Πράγματι, έχει δειχθεί ότι υδατικά H. pylori-εκχυλίσματα αναστέλλουν την απόπτωση των ουδετεροφίλων καταστέλλοντας την ενεργοποίηση των κασπασών 8 και 3, την έκφραση του Fas συνδέτη (FasL), του υποδοχέα Fas και του υποδοχέα R1 του ΤNF (TNF-R1) στην επιφάνεια των ουδετεροφίλων και από την άλλη πλευρά, ενεργοποιώντας την αντιαποπτωτική Bcl-XL πρωτεΐνη.11,12
Υφίστανται δεδομένα που δείχνουν ότι το H. pylori εμπλέκεται στην επαγωγή ατροφικής γαστρίτιδας του σώματος που σχετίζεται με την αυτοάνοση γαστρίτιδα ή γαστρίτιδα τύπου Α.13 Πράγματι, τα 2/3 των ασθενών με ατροφική γαστρίτιδα του σώματος έχουν ένδειξη H. pylori λοιμώξεως.13 Το εύρημα αυτό υποδηλώνει ότι η ατροφική γαστρίτιδα του σώματος απαρτίζει ένα φάσμα βλάβης όπου το H. pylori είναι παράγοντας-κλειδί ικανό να επάγει γαστρική ατροφική βλάβη14 και γαστρική αυτοανοσία (το H. pylori επάγει την παραγωγή αυτοαντισωμάτων τα οποία αντιδρούν με πρωτεΐνη των τοιχωματικών κυττάρων).13,15
Επιπλέον, συζητείται η εμπλοκή του H. pylori στον συσχετισμό χρόνιας ατροφικής γαστρίτιδας του σώματος (κακοήθους αναιμίας) και της πρωτοπαθούς χολικής κιρρώσεως, δύο νοσολογικών οντοτήτων που χαρακτηρίζονται από κοινή ανοσολογική εξεργασία εναντίον των εξωκρινών αδενικών ιστών του στομάχου και χοληφόρου συστήματος, αντίστοιχα.15,16 Η θεωρία της μοριακής μιμητικής εστιαζόμενη στην H. pylori λοίμωξη, δυνατόν να ευθύνεται για την έναρξη αυτοανόσου αποκρίσεως σε προδιαθετημένο ξενιστή, λόγω διασταυρούμενης αντιδράσεως (cross-reactivity) μεταξύ αντιγόνων του βακτηριδίου, γαστρικού βλεννογόνου και χοληφόρου συστήματος.15
Κατά συνέπεια, το H. pylori δυνατόν να επάγει αυτοάνοσες αποκρίσεις που παίζουν παθογενετικό ρόλο στην ανάπτυξη πρωτοπαθούς χολικής κιρρώσεως και ατροφικής γαστρίτιδας του σώματος. Εντούτοις, η πιθανή συσχέτιση H. pylori λοιμώξεως και πρωτοπαθούς χολικής κιρρώσεως χρήζει μελλοντικής προσεγγίσεως.
Σε μεγάλο αριθμό μελετών διαπιστώνεται επιτάχυνση της αναπτύξεως ατροφικής γαστρίτιδας του σώματος κατά τη διάρκεια θεραπείας συντηρήσεως με αναστολείς των Η2 υποδοχέων ή PPIs. Αντίθετα, η εκρίζωση του H. pylori πιθανόν να παρεμποδίζει την ανάπτυξη ατροφικής γαστρίτιδας.17 Η λεμφοκυτταρική γαστρίτιδα, η οποία έχει συσχετισθεί με την H. pylori λοίμωξη και κοιλιοκάκη, χαρακτηρίζεται από συσσώρευση λεμφοκυττάρων στην επιφάνεια του επιθηλίου και στα βοθρία του γαστρικού βλεννογόνου, είναι δε το αποτέλεσμα ειδικής ανοσοαπόκρισης στην H. pylori λοίμωξη.18
Η εκρίζωση του H. pylori σε ασθενείς με λεμφοκυτταρική γαστρίτιδα προκαλεί σημαντική βελτίωση της ενδοθηλιακής λεμφοκυτταρικής (ΙΕL) διηθήσεως, της φλεγμονής του σώματος του στομάχου και των δυσπεπτικών συμπτωμάτων.18 Η χρήση μη στεροειδών αντιφλεγμονωδών φαρμάκων (NSAIDs) διεγείρει την ουδετεροφιλική προσκόλληση και μετανάστευση, προκαλώντας έτσι άμεση γαστρική βλάβη (από τα διηθημένα ουδετερόφιλα μέσω παραγωγής ROMs).19,20
Ειδικότερα, η εξαρτώμενη από το μόριο προσκόλλησης ICAM-προσκόλληση των κυκλοφορουμένων ουδετεροφίλων στα μετατριχοειδικά φλεβίδια παίζει κριτικό ρόλο για την NSAIDs-προκαλούμενη γαστροπάθεια σε πειραματόζωα.21 Τα NSAIDs (ινδομεθακίνη) διεγείρουν την έκφραση του TNF-α, ο οποίος αυξάνει την προσκόλληση των ουδετεροφίλων στα τριχοειδή της γαστρικής μικροκυκλοφορίας ενεργοποιώντας την έκφραση του ICAM στα κύτταρα του ενδοθηλίου.21 Η αύξηση της ΙCAM-έκφρασης μεσολαβείται με ενεργοποίηση του πυρηνικού παράγοντα μεταγραφής NFκΒ. H ενεργοποίηση του NFκΒ απαιτεί αρχικά πρωτεολυτική διάσπασή του από τον αναστολέα ΙκΒ οποίος σε κανονικές συνθήκες απομονώνει τον NFκΒ στο κυτταρόπλασμα. Ο καταβολισμός του αναστολέα (πρωτεόλυση) επιτυγχάνεται μέσω της ενδοκυτταρικής πρωτεολυτικής οδού των πρωτεασών (proteasome-pathway of intracellular proteolysis). Μετά την πρωτεόλυση του αναστολέα, απελευθερώνεται ο ΝFκΒ, εισέρχεται στον πυρήνα και επάγει την μεταγραφή. Η γνώση της αλληλουχίας αυτής των αντιδράσεων δυνατόν να έχει πρακτικές εφαρμογές. Για παράδειγμα, η προκαλούμενη από ινδομεθακίνη-γαστροπάθεια και η συνοδός αύξηση της ICAM έκφρασης παρεμποδίζεται με χρήση αναστολέων πρωτεασών.21
Επίσης η χρήση πεντοξυφυλλίνης (pentoxyphylline), η οποία αναστέλλει τις δράσεις του TNF-α, προστατεύει από την προκαλούμενη από ινδομεθακίνη γαστροπάθεια.22 Η in vivo εφαρμογή αναστολέων των πρωτεασών ή άλλων σχετικών παρεμβάσεων απαιτούν συνεχή έρευνα με την ελπίδα αναπτύξεως παραγόντων με δυνητική κλινική εφαρμογή στον άνθρωπο.23
Η γαστρική βλάβη από NSAIDs-θεραπεία είναι ελάχιστη σε ουδετεροπενικά ζώα (μετά χορήγηση ειδικών αντι-ουδετεροφιλικών παραγόντων). Αντίθετα, τα γαστρικά ουδετερόφιλα αυξάνουν την συχνότητα γαστρικής βλάβης-έλκους σε μακροχρόνια NSAIDs θεραπεία. Επειδή η παρουσία ουδετεροφίλων λευκοκυττάρων χαρακτηρίζει την H. pylori-λοίμωξη, η εκρίζωση της λοιμώξεως δυνατόν να παρεμποδίζει την ανάπτυξη των NSAIDs-σχετιζόμενων γαστρικών βλαβών. Πράγματι, η εκρίζωση του H. pylori πρίν την έναρξη NSAIDs αγωγής μειώνει την εμφάνιση των NSAIDs-προκαλούμενων γαστρικών βλαβών (πεπτικών ελκών).24 Η κυκλοοξυγενάση (COX)-2 (prostaglandin synthase 2) είναι μια μεμβρανική (membrane-bound) γλυκοπρωτεΐνη που λειτουργεί στην παραγωγή προστανοειδών (prostanoids) από το αραχιδονικό οξύ. Η έκφρασή της περιορίζεται σε ωρισμένους ιστούς αλλά επάγεται με ποικίλα ερεθίσματα. Αυξημένη COX-2 έκφραση παρατηρείται σε πειραματικά μοντέλα φλεγμονής και στις ανθρώπινες φλεγμονώδεις νόσους.
Επιπλέον, η COX-2 είναι μιτογόνος και ογκογόνος σε in vitro μελέτες. Nεότερα δεδομένα ενοχοποιούν την COX-2 στην καρκινογένεση του στομάχου. Εκτός της χρόνιας φλεγμονής, η COX-2 εμπλέκεται και στην επιθηλιακή κυτταρική αύξηση. Πρόσφατες μελέτες δείχνουν ότι η NSAIDs-επαγόμενη γαστροπάθεια δεν προκαλείται μόνο με αναστολή της COX-1 αλλά απαιτεί ταυτόχρονη αναστολή της COX-1 και της COX-2.25 Πιθανολογείται ότι η μόνον η αναστολή της COX-1 οδηγεί σε αύξηση της COX-2 έκφρασης, η οποία εξουδετερώνει τις NSAIDs-τοξικές επιδράσεις, όπως την γαστρική υπερκινητικότητα (η οποία παίζει σπουδαίο ρόλο στην παθογένεση της NSAIDs-προκαλούμενης γαστροπάθειας) και τα δυσμενή συμβάντα λόγω αναστολής των προσταγλανδινών από την COX-1.25
Για τον κλινικό, ενδοσκόπο και παθολογοανατόμο παρουσιάζει επιπλέον μεγάλο ενδιαφέρον μια ποικιλία άλλων τύπων γαστρίτιδων-γαστροπαθειών που περιλαμβάνουν: ‘αλκοολική γαστρίτιδα’, τραύμα και ακτινοβολία, αγγειακές βλάβες, βλάβη από παλλινδρόμηση 12/λικού περιεχομένου, ιδιοπαθείς διαβρώσεις, μη διαβρωτικές γαστρίτιδες, λοιμώξεις από βακτηρίδια (φυματίωση), ιούς (κυτταρομεγαλοϊός, ιός έρπητος απλού ή ζωστήρος), μύκητες (Candida albicans, histoplasmosis) ή παράσιτα (Giardia lamblia, Cryptosporidium), σαρκοείδωση, ηωσινοφιλική γαστρίτιδα, νόσο Crohn’s, κοκκιωματώδη γαστρίτιδα, σύνδρομο Zollinger-Ellison, εστιακή λεμφοειδική υπερπλασία (ψευδολέμφωμα), υπερτροφική γαστροπάθεια και νόσο Menetrier’s.26
Βιβλιογραφία
- Κουντουράς Ι. Μελέτη χυμικής και κυτταρικής ανοσίας σε ατροφική γαστρίτιδα, Διδακτορική διατριβή, ΑΠΘ, Θεσσαλονίκη 1980:14-107
- D’Ellos MM, et al. H+,K+ -ATPase (proton pump) is the target autoantigen of the Th1-type cytotoxic T cells in autoimmune gastritis. Gastroenerology 2001;120:377-386
- Clays D, et al. Neonatal injection of native proton pump antigens induces autoimmune gastritis in mice. Gastroenterology 1997;113:1136-1145
- Katakai T, et al. Selective accumulation of type 1 effector cells expressing P-selectin ligand and/or alpha(4)beta(7)-integrin at the lesions of autoimmune gastritis. Int Immunol 2002;14:167-75.
- Teshima S, et al. Guinea pig gastric mucosal cells produce abundant superoxide anion through an NADPH oxidase-like system. Gastroenterology 1998;115:1186-96.
- Drake IM, et al. Reactive oxygen species activity and lipid peroxidation in Helicobacter pylori associated gastritis: relation to gastric mucosal ascorbic acid concentrations and effect of H pylori eradication. Gut 1988;42:768-71.
- Hiyama T, et al. K-ras mutation in helicobacter pylori-associated chronic gastritis in patients with or without gastric cancer. Int J Cancer 2002;97:562-6.
- Zhang QB, et al. Association of cytotoxin production and neutrophil activation by strains of Helicobacter pylori isolated from patients with peptic ulceration and chronic gastritis. Gut 1996;38:841-5.
- Basso D, et al. Polymorphonuclear oxidative burst after Helicobacter pylori water extract stimulation is not influenced by the cytotoxic genotype but indicates infection and gastritis grade. Clin Chem Lab Med 1999;37:223-9.
- Panes J, Granger DN. Leukocyte-endothelial cell interactions: Molecular mechanisms and implications in gastrointestinal disease. Gastroenterology 1998;114:1066-90.
- Kim JS, et al. Caspase-3 activity and expression of Bcl-2 family in human neutrophils by Helicobacter pylori water-soluble proteins. Helicobacter 2001;6:207-15
- Kim JS, et al. Inhibition of apoptosis in human neutrophils by Helicobacter pylori water-soluble surface proteins
- Annibale B, et al. Two-thirds of atrophic body gastritis patients have evidence of Helicobacter pylori infection. Helicobacter 2001;6:225-33
- Sande N, st al. Inreased risk of developing atrophic gastritis in patients infected with Cag+ Helicobacter pylori. Scand J Gastroenterol 2001;36:928-33
- Dohmen K, et al. Atrophic corpus gastritis and Helicobacter pylori infection in primary biliary cirrhosis. Dig Dis Sci 2002;47:162-9.
- Takahashi T, et al. A female with asymtomatic primary biliary cirrhosis associated with pernicious anemia. J Gastroenterol Hepatol 2001;16:1420-4
- Schenck BE, et al. Effect of Helicobacter pylori eradication on chronic gastritis during omeprazole therapy. Gut 2000;46:615-621.
- Hayat M, et al. Effects of Helicobacter pylori eradication on the natural history of lymphocytic gastritis. Gut 1999;45:495-498
- Κουντουράς Ι. Οξειδωτικό στρες και παθήσεις στομάχου. Πρακτικά 2ου Πανελληνίου Συνεδρίου Ελευθέρων Ριζών και Οξειδωτικού Στρες. Θεσσαλονίκη 2000:30-47.
- Kountouras J, et al. Reactive oxygen metabolites and upper gastrointestinal diseases. Hepato-Gastroenterol 2001;48:743-751
- Brano SJ, et al. Role of the proteasome in rat indomethacin-induces gastropathy. Gastroenterology 1999;116:865-873.
- Appleyard CB, et al. Tumor necrosis factor mediation of NAID induced gastric damage: role of leukocyte adherence. Am J Physiol 1995;270:G42-G48
- Bush KT, Nigam SK. Less degradation, more shock, please. Gastroenterology 1999;116:994-996.
- Taha AS, et al. Neutrophils, Helicobacter pylori, and nonsteroidal anti-inflammarory drug ulcers. Gastroenterology 1999;116:254-8.
- Takeuchi K, et al. Roles of COX-1 and COX-2 inhibition in NSAID-induced gastric damage in rats: Relation to gastric hypermotility. Gastroenterology 2001;120 (suppl 1):3020.
- Weinstein WM. Other types of gastritis and gastropathies, including Menetrier’s disease. In: Sleisenger & Fordtran’s Gastrointestinal and Liver disaseases. Saunders WB, Philadelphia,1998:711-732.
Πρόσθετη βιβλιογραφία
- Katsinelos P, Zavos C, et al. Severe acute haemorrhagic gastritis controlled by hydrogen peroxide. Eur J Gastroenterol Hepatol 2006 Jan;18(1):107-10.
- Kountouras J, Zavos C, et al. Helicobacter pylori may be involved in cognitive impairment and dementia development through induction of atrophic gastritis, vitamin B-12–folate deficiency, and hyperhomocysteinemia sequence. Am J Clin Nutr 2007 Sep;86(3):805-6.
- Zavos C, et al. An unusual case of unresectable advanced gastric adenocarcinoma with macroscopic appearance mimicking erosive gastritis. Dig Liver Dis 2008 Mar;40(Suppl 1):S182; PO.31.
- Zavos C, et al. An unusual case of unresectable advanced gastric adenocarcinoma with macroscopic appearance mimicking erosive gastritis. Hepatogastroenterology 2008 Oct;55(Suppl I):A174; P155, Ref No: 38.
